De Gliomen
In het hoofd kunnen allerlei soorten gezwellen (= tumoren) voorkomen. In dit stuk gaat het alleen over tumoren die uitgaan van het hersenweefsel zelf. Andere soorten van tumoren die in het hoofd voorkomen zijn bijvoorbeeld meningeomen (tumoren uitgaande van de hersenvliezen), metastasen (uitzaaiingen van een kanker die ergens anders in het lichaam is ontstaan), hypofysetumoren (tumoren van de hersenklier) en dergelijke. Deze tumoren komen in dit hoofdstuk niet aan de orde. Het hersenweefsel is opgebouwd uit hersencellen (of neuronen), die liggen in bindweefsel (of glia). Dit bindweefsel bestaat weer uit een tweetal soorten cellen, de astrocyten en de oligodendrocyten. Hersentumoren ontstaan in de overgrote meerderheid van de gevallen uit het bindweefsel, de glia, en worden daarom wel gliomen genoemd. Er zijn enkele zeldzame tumorsoorten die uit de eigenlijke hersenencellen, de neuronen, voortkomen.
Het hersenweefsel is opgebouwd uit hersencellen (of neuronen), die liggen in bindweefsel of glia. Dit gliaweefsel bestaat weer uit een tweetal soorten cellen, de astrocyten en de oligodendrocyten. Hersentumoren ontstaan in de overgrote meerderheid van de gevallen uit het bindweefsel, de glia, en worden daarom wel gliomen genoemd. Er zijn enkele zeldzame tumorsoorten die uit de eigenlijke hersenencellen voortkomen.
Ontstaan en voorkomen
Over hoe en waardoor hersentumoren ontstaan is vrijwel niets bekend. Wel is duidelijk dat erfelijke factoren mede een rol spelen, alhoewel het niet duidelijk is in welke mate. Het gaat in elk geval niet om een erfelijke ziekte. Veel meer is het waarschijnlijk zo, dat de aanleg om een hersentumor te krijgen al bij de geboorte aanwezig is. Van geen enkele omgevingsfactor is een relatie met het ontstaan van hersentumoren aangetoond (voeding, roken, alcohol, straling, en dergelijke). Ook voor een verband met het gebruik van de mobiele telefoon is er geen bewijs. De tumoren ontstaan meestal rond het 50e tot 60e levensjaar, maar kunnen ook veel eerder of later optreden. Wat dat betreft is er een grote spreiding. Mannen en vrouwen lopen min of meer in gelijke mate het risico een hersentumor te krijgen. Hersentumoren die bij kinderen (tot ca. 15 jaar) ontstaan vormen een bijzondere categorie, zowel wat betreft hun aard als behandeling en zullen daarom hier verder buiten beschouwing worden gelaten.
Soorten van tumoren
Gliomen worden onderscheiden in twee types. De typering hangt samen met het type bindweefsel van waaruit de tumor groeit. Tumoren die afkomstig zijn uit de astrocyten noemt men astrocytomen, degene die groeien uit de oligodendrocyten heten oligodendrogliomen. Er zijn ook menggliomen met kenmerken van beide celtypen, oligo-astrocytomen genoemd.
Gliomen worden op grond van eigenschappen die de patholoog-anatoom met behulp van de microscoop ziet ingedeeld in vier graderingen. Bij het indelen worden systemen die zijn ontwikkeld door de WHO gebruikt. Deze kenmerken die de basis vormen van de gradering zijn uit celdichtheid, verschil in celkerngrootte, verdikking van bloedvaten, hoeveelheid celdelingen en gebieden van weefselverval. Hoe meer van deze kenmerken gezien worden hoe hoger de gradering van het glioom. De gradering heeft een schaal van 1 tot 4.
- Graad I. Hierbij is sprake van tumor die zich vrijwel zo gedraagt als normaal hersenweefsel. Deze diagnose wordt in de praktijk vrijwel nooit afgegeven.
- Graad II. Hierbij is in elk geval sprake van toegenomen groei van de glia, echter zonder dat er kenmerken van kwaadaardigheid worden gezien. Bij graad I en graad II spreekt men van een laaggradig glioom.
- Graad III. Bij deze gradering worden kenmerken van kwaadaardigheid gezien zoals een verandering van de celkernen en toename van de groei van de bloedvaten.
- Graad IV. Bij dit type is er duidelijk sprake van een ongeremd groeiende tumor, die zo snel groeit dat de bloedvaten het niet meer kunnen bijhouden en er weefselverval ontstaat. Bij graad III en IV spreekt men daarom van een hooggradig glioom.
Onderstaand beelden van verschillende gliomen zoals ze er na kleuring onder de microscoop uit zien

Figuur 1. A. Glioblastoom: met de gebruikelijke (hematoxyline-eosine) kleuring is er aan de randen grote celdichtheid te zien. Iedere paarsgekleurde ronde of ovale structuur is de kern van een cel. In het midden is een lege ruimte waar de cellen zijn afgestorven, waarschijnlijk doordat er vanwege hun snelle groei een grote behoefte is aan grondstoffen, waarvan de voorziening niet door de bloedvaten kon worden bijgehouden.
B. Astrocytoom graad II: er is hier een speciale kleuring toegepast, waarmee een speciaal celbestanddeel wordt aangetoond dat specifiek in astrocytomen voorkomt en hier donkerbruin aankleurt.
C. Oligodendroglioom: met de hematoxyline-eosine kleuring zien we hier ronde cellen die typisch zijn voor oligodendroglia
De bovengenoemde gradering zegt niet altijd alles over het biologisch gedrag van een tumor bij een individuele patiënt. Dat betekent dat een tumor met een hogere graad soms toch minder snel terug komt dan je op grond van het microscopisch beeld zou verwachten. Laaggradige tumoren kunnen op den duur vaak ontaarden in een hogere gradering, zodat op dat moment voor een ander beleid kan worden gekozen.
De afgelopen jaren is er een grote hoeveelheid moleculaire DNA diagnostiek ontwikkeld die aanvullende informatie kan gaan geven over prognose en behandelings gevoeligheid. De bruikbaarheid van deze techniek moet nog worden geëvalueerd en doorontwikkeld voordat het een vaste plaats krijgt.
Naast de bovengenoemde meest gangbare een eenvoudige indeling komen er nog andere vormen van primaire hersentumoren voor. Deze worden o.a. ook behandeld in de tekst over bijzondere- en kindertumoren.
Wanneer bij een hersentumor gesproken wordt van kwaadaardigheid, dient men zich te realiseren dat dit een ander soort van kwaadaardigheid is dan wordt gezien bij andere gezwellen in het lichaam: een hersentumor groeit niet door bestaande barrières en zaait ook vrijwel nooit uit naar andere organen. De kwaadaardigheid zit hem in het feit dat een hersentumor bijna altijd weer terugkomt (een hele enkele uitzondering daargelaten) en daarnaast leidt tot aantasting van het hersenweefsel waardoor uitval van functies.
Symptomen of verschijnselen
De verschijnselen van een hersentumor hangen enerzijds samen met de groei van de tumor waardoor verhoging van de druk in het hoofd ontstaat, anderzijds met de plaats waar de tumor groeit. Verschijnselen van drukverhoging kunnen zijn: hoofdpijn, vooral bij activiteiten die zelf nog eens de druk laten toenemen (b.v. bukken, niezen, persen), eventueel gepaard gaande met misselijkheid en braken. Wanneer de tumor groeit in een neurologisch “stil” gebied, d.w.z. een deel van de hersenen waar uitval van functie minder snel opvalt, kan deze enige tijd onopgemerkt groeien. Behalve uit verhoging van de druk bestaan de verschijnselen dan vaak uit psychische veranderingen zoals trager worden of juist minder geremd zijn. Bij groei in een deel van de hersenen waar b.v. de bewegingen gelegen zijn kunnen verlammingsverschijnselen optreden, die zich dan aan de andere lichaamshelft manifesteren, of spraakstoornissen. (Zie figuur 2) Tenslotte kunnen ook nog epileptische toevallen het gevolg zijn van een hersentumor. In een heel enkel geval kan een bloeding in een tumor optreden, iets wat het stellen van een juiste diagnose aanvankelijk kan bemoeilijken.
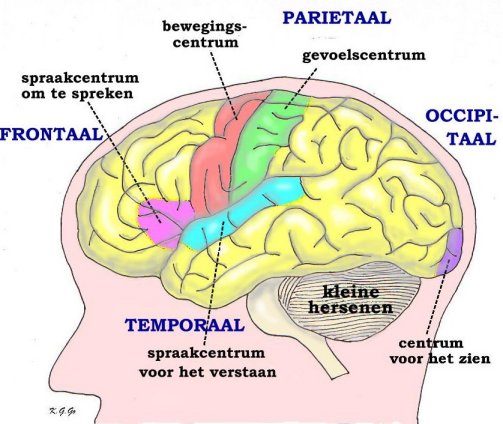
Figuur 2: Schematische voorstelling van de linker hersenhelft met de centra voor beweging, gevoel, spraak (om te spreken en om te verstaan), en voor het zien, waarvan beschadiging een stoornis geeft van de betreffende functie. Naast deze zogenaamde eloquente gebieden zijn in geel aangegeven “stille” gebieden, waar functies zetelen, die niet opvallend gestoord raken bij beschadiging van het gebied, omdat ze kennelijk vervangbaar zijn door soortgelijke functies in andere gebieden.
Aanvullend onderzoek
Niet iedere hoofdpijn is het gevolg van een hersentumor. Integendeel, meestal gaat het om een onschuldige vorm van hoofdpijn. Wanneer iemand echter over hoofdpijn klaagt die daar nooit eerder last van had en bovendien wanneer er sprake is van misselijkheid of braken kan nader onderzoek gerechtvaardigd zijn. Het best beschikbaar is de MRI-scan, een onderzoek dat veel beter de details laat zien dan een CT-scan en ook in staat is een eventueel proces in drie richtingen te laten zien.
Indien het vermoeden bestaat dat de tumor zich in de buurt van belangrijke hersendelen bevindt kan een fMRI (dat is een functionele MRI (fMRI)) extra informatie verschaffen. Dit onderzoek is een betrekkelijk nieuwe techniek, die gebaseerd is op de hierboven genoemde MRI-techniek, maar als doel heeft om bepaalde gebieden op het hersenoppervlak zichtbaar te maken. Het principe van dit onderzoek is dat tijdens het scannen door de patiënt bepaalde opdrachten worden uitgevoerd (bijvoorbeeld het “in het hoofd” oplezen van bepaalde woordjes die op een scherm geprojecteerd worden, of het heen en weer bewegen van een duim of een wijsvinger). Door een scan-medewerker/onderzoeker kunnen bepaalde delen van het lichaam worden aangeraakt (met een kwastje over de handrug of voetrug strijken). Ook meer ingewikkelde cognitieve testen kunnen worden gevraagd. Op deze manier worden bepaalde delen van de hersenen die overeenkomen met de functie die wordt gestimuleerd, actiever gemaakt. Deze verhoogde activiteit leidt tot een verhoogde doorbloeding in die delen van de hersenen. Die verhoogde doorbloeding wordt weer door de scan “gelezen”en uiteindelijk door de computer vertaald in een plaatje waarop dat hersengebied “oplicht”. Op deze manier kan worden bepaald of een hersentumor in- of nabij- een gebied ligt dat van groot belang is voor belangrijke functies zoals spraak, taalbegrip, bewegen (schrijven!), gevoel, enz. Een dergelijke functionele MRI wordt uitsluitend gemaakt indien men denkt dat bij operatie het risico bestaat op beschadiging van deze gebieden. Door gebruik te maken van de informatie die de fMRI heeft opgeleverd, kunnen deze “risicogebieden” tijdens operatie worden vermeden.
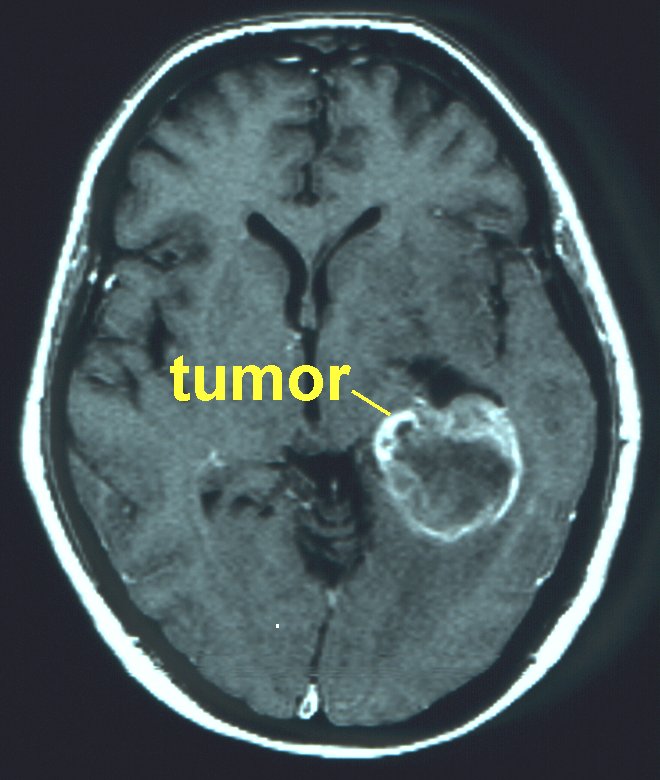
Fig. 3 rechts: Voorbeeld van een MRI, waarbij een dwarsdoorsnede door de schedel wordt getoond die evenwijdig is aan de schedelbasis. De tumor is de wit aankleurende vlek. De tumor ligt in dit geval tamelijk diep, minimaal 2 cm onder de hersenschors.
Soms blijkt uit de scans direct al dat er sprake is van een proces dat niet voor operatieve verwijdering in aanmerking komt.
Het is belangrijk om te bedenken dat het aan de hand van een scan niet mogelijk is een (definitieve) uitspraak te doen over het type en de geaardheid van een tumor! Dat is uitsluitend mogelijk aan de hand van de weefseldiagnose, met andere woorden: alleen door onderzoek van een stukje van de tumor door de patholoog (dus onder de microscoop, in het pathologisch laboratorium) kan een uitspraak worden gedaan over “wat voor tumor het is”. Vaak duurt het een tot twee weken na de operatie voordat er een definitieve diagnose kan worden gesteld. De neuro-pathologen laten bij enige onzekerheid de coupes hersenweefsel ook door collega pathologen in een ander centrum beoordelen. Dit duurt soms nog langer. Deze periode van onzekerheid is buitengewoon spannend voor de patient en familie. Zekerheid van een diagnose en afstemmen van een behandelplan zijn vooral bij hersentumoren erg belangrijk.
Behandeling
Het voornaamste probleem bij de behandeling van een glioom is dat de tumorcellen van het glioom niet als een eenheid bij elkaar blijven, maar zich verspreiden langs de verbindende vezelbanen van de hersenen. Zo bevinden tumorcellen zich in een vroeg stadium op afstand van het centrum van het glioom tussen de normale hersencellen. Gliomen zaaien niet uit naar andere organen. De behandeling van een glioom heeft niet als doel genezing maar het uitstellen van verdere ontaarding, nieuwe aangroei en doorgroei, dus het verbeteren van verschijnselen (verbetering van kwaliteit van leven) en het verlengen van de levensverwachting. Genezing van een glioom is met de huidige beschikbare behandelingen niet mogelijk.
Onder neurochirurgen wordt vaak gehoord dat men, ondanks vooruitgang op allerlei gebieden, met de behandeling van de hersentumor niet erg veel is opgeschoten sinds het begin van de ontwikkeling van het vak. Ten dele is dit ook zo. Hoewel door de vooruitgang op het gebied van afbeelding (CT, MRI, fMRI en PET en andere soorten scans), narcose, operatietechnieken en intensive care de behandeling veel beter is geworden, is men nog altijd niet in staat een hersentumor volledig onder controle te krijgen, d.w.z. te genezen. Dat komt omdat ondanks alle inspanningen een hersentumor vrijwel altijd weer terug komt. Iedere neurochirurg heeft in zijn praktijk echter een of twee patiënten bij wie de tumor niet is teruggekomen, en daarom is het voorspellen van een beloop bij een individuele patiënt zo moeilijk. Als je weet dat van de 100 patiënten de tumor bij 98 na een bepaalde tijd weer terugkomt, dan zegt dat wel iets over de kwaadaardigheid van de tumor, maar in een gesprek met een individuele patiënt weet je niet of deze tot de 98 of tot de 2 anderen behoort.
Wanneer aan de hand van het bovengenoemde onderzoek is gebleken dat er sprake is van een hersentumor, zal in de meeste gevallen worden besloten tot verwijzing naar de neurochirurg. Daar zal worden gesproken over de mogelijkheden of onmogelijkheden van operatieve behandeling. In de meeste gevallen zal er dan nog geen definitieve diagnose bekend zijn, immers er zal eerst tumorweefsel moeten worden verwijderd en door de patholoog moeten worden onderzocht. Pas dan zal de definitieve diagnose bekend zijn. Om weefsel te verkrijgen, is een operatie noodzakelijk. Zoals hierboven al is aangegeven, kan het doel van een operatie vanwege een hersentumor tweeledig zijn:
- allereerst om tot de definitieve diagnose te komen, en
- om de tumor grotendeels te verwijderen
Vaak gebeurt dit tijdens één en dezelfde operatie. Soms is het zo dat éérst een kleine operatie wordt uitgevoerd, waarbij alleen een klein stukje van de tumor wordt verwijderd, teneinde een weefseldiagnose te krijgen. Dit noemt men het nemen van een biopsie. Aan de hand van die diagnose kan het zijn dat vervolgens een tweede operatie word uitgevoerd, meestal dan een grotere ingreep, met als doel (zoveel mogelijk van) de tumor te verwijderen. Vaak zal het zo zijn dat meteen wordt gekozen voor een dergelijke grote(re) operatie. In dat geval wordt een luikje in de schedel gemaakt (craniotomie), teneinde een toegang te verschaffen naar het deel van de hersenen waar zich de tumor bevindt.
Het kan zijn dat de neurochirurg besluit om de operatie te doen nadat de patient gliolan heeft ingenomen zodat de tumor te visualiseren is tijdens de operatie, klik hier om verder te lezen over gliolan.
Biopsie
Een biopsie is niets meer dan het verwijderen van een stukje (tumor)weefsel, ten behoeve van pathologisch onderzoek. Dit stukje weefsel wordt door de patholoog onderzocht, met de bedoeling om tot een duidelijke “weefseldiagnose” te komen. Met andere woorden, de patholoog moet antwoord geven op de vraag: “wat is het voor een soort tumor”. Het nemen van alleen een biopsie, zonder dat wordt geprobeerd om de tumor te verwijderen, zal meestal worden gedaan indien de tumor op een ongunstige plaats in de hersenen (zoals bijvoorbeeld nabij de hersenstam) ligt. Soms is het niet zeker of de afwijking op een scan een gezwel is, maar zou ook sprake kunnen zijn van een ontsteking of een andere afwijking. Om daarover informatie te krijgen, kan het in die gevallen de voorkeur hebben om eerst een biopsie te nemen, en pas nadat een diagnose gesteld is te besluiten of een grote(re) operatie noodzakelijk is.
Een biopsie kan op verschillende manieren worden genomen. In de praktijk zal er altijd een boorgaatje in de schedel moeten worden gemaakt, waardoorheen een biopsie-naald naar binnen in de hersenen kan worden geschoven, tot op de plaats waar zich de afwijking bevindt. De huidige methode om met de biopsienaald op de juiste plaats binnen de hersenen uit te komen, is door gebruik te maken van neuronavigatie. Hierbij wordt voorafgaand aan de biopsie een speciaal MRI-onderzoek verricht, dat geschikt is voor deze navigatie. Met behulp van een speciale computer wordt een drie-dimensionaal beeld van de hersenen geconstrueerd, dat als het ware wordt geprojecteerd binnen de schedel van de patiënt. Hierdoor is de neurochirurg in staat om precies op de gewenste plek een opening te maken in de schedel, en vervolgens zo een biopsie te nemen. Deze neuronavigatietechniek kan ook worden toegepast bij het uitvoeren van grote hersenoperaties (zie hierna). Het voordeel van de neuronavigatiemethode is dat het niet meer nodig is om een frame op de schedel van de patient te plaatsen. Wel is het zo dat het hoofd van de patient moet worden gefixeerd met een speciale klem, om te voorkomen dat het hoofd van positie veranderd tijdens de ingreep. Dan kloppen namelijk de posities niet meer, en komt de operateur met zijn biopsienaald of operatieinstrumenten niet op de juiste plek uit. De voorloper van de navigatie techniek maakt gebruik van een speciaal frame (het stereotactisch frame) dat tevoren wordt vastgeschroefd op de schedel van de patiënt. Meestal kan dat onder plaatselijke verdoving. Met dit frame op het hoofd worrdt een scan gemaakt. De coordinaten van de tumor ten opzichte van het frame, en de naaldpunt positie voor biopsie en het naaldtraject worden berekend. En via een klein gaatje wordt de biopsie genomen.
Het nadeel van het verwijderen van maar een klein stukje van de tumor, is dat er een kleine kans is dat niet de correcte diagnose wordt gesteld:
- doordat er geen afwijkend weefsel wordt gezien door de patholoog
- doordat er te weinig materiaal is verkregen, zodat de patholoog geen definitief uitsluitsel kan geven
- doordat de kans bestaat dat de tumor uit verschillende types/graderingen bestaat (zie boven). Het risico is dan dat een stukje weefsel uit een “laaggradig” gebied is verwijderd, terwijl er iets verderop in dezelfde tumor een gebied met een hogere gradering is. Dan wordt ten onrechte geconcludeerd dat het om een “laaggradige tumor”gaat, terwijl het tumorgedrag wordt bepaald door het (niet ontdekte) hooggradige gebied. Dit noemt men in het jargon de “sample error”, oftewel de fout die ontstaat doordat slechts een klein stukje van de gehele tumor is onderzocht. In het algemeen kan worden gesteld dat de kans op een juiste uitslag het grootste is als een grote hoeveelheid van de tumor door de patholoog is onderzocht: hoe groter de “sample”, des te betrouwbaarder de uitslag.
Craniotomie
Een craniotomie heeft tot doel om zoveel mogelijk of eventueel al het zichtbare tumorweefsel te verwijderen. Of dat mogelijk is hangt sterk af van het type tumor, en van de plek waar de tumor zich in de hersenen bevindt. De meeste gliomen zullen niet radicaal verwijderd kunnen worden. Toch zal in de meeste gevallen worden overgegaan tot een craniotomie, omdat het op die manier mogelijk is om:
- zoveel mogelijk tumorweefsel te verwijderen
- druk die door de tumor op de structuren binnen de schedel wordt uitgeoefend op te heffen. Door het opheffen van deze “massawerking”, kunnen verschijnselen als hoofdpijn, uitvalsverschijnselen (krachtvermindering, spraakstoornissen, gedragsveranderingen, etc) verbeteren. Ook kan door middel van operatie de eventueel aanwezige epilepsie verbeteren.
Tijdens een craniotomie kan gebruik worden gemaakt van allerlei hulpmiddelen, waardoor de chirurg instaat is om veiliger te werken (vermijden van belangrijke hersengebieden) en tijdens de operatie beter te controleren of hij voldoende tumorweefsel heeft verwijderd.
Hierboven is al de neuronavigatie genoemd. Daarmee kan tijdens operatie aan de hand van een speciale MRI-scan (vooraf aan de operatie gemaakt) worden genavigeerd naar de tumor, en rekening worden gehouden met belangrijke structuren om de tumor heen.
Daarnaast bestaat de mogelijkheid om tijdens de operatie de hersengebieden in kaart te brengen die nodig zijn voor het bewegen van arm of been, voor de spraak, voor het gevoel, enz. Tijdens onderdelen van een dergelijke operatie kan het wenselijk zijn dat met de patiënt wordt gecommuniceerd. Dan moet de patiënt wakker zijn (“awake craniotomy”), en meewerken. In speciale gevallen wordt deze techniek toegepast.
Een andere methodiek is het gebruik van een speciale stof (5-ALA), die enkele uren voor operatie aan de patiënt wordt toegediend. Deze stof wordt opgenomen in het lichaam, en in verhoogde mate opgenomen in bepaalde gliomen. Door tijdens het opereren het tumorgebied met een licht van een speciale golflengte te beschijnen, wordt een fluorescentie (“oplichten”) gezien op die plaatsen waar zich glioomcellen bevinden. Op die manier is het mogelijk om op een plek waar “met het blote oog” geen onderscheid meer kan worden gezien tussen de normaal hersenweefsel en tumorweefsel (die grens vervaagt aan de randen van de tumor), meer tumorweefsel te verwijderen dan zonder die stof het geval zou zijn. Alleen hooggradige gliomen nemen deze stof op, bij dit sort tumoren is een uitgebreidere resectie hierdoor mogelijk. Bij laaggradige gliomen en andersoortige tumoren is deze techniek niet zinvol.
Een ander hulpmiddel tijdens hersentumor chirurgie is de echografie, waarbij tijdens de operatie met behulp van een echo apparaat (vergelijkbaar met het apparaat waarmee tijdens een zwangerschap kan worden onderzocht hoe het met het kindje in de baarmoeder gaat) de tumor kan worden gelokaliseerd, en vervolgens ook kan worden gecontroleerd of er nog tumorweefsel is achtergebleven. Dat kan dan alsnog (mits op een veilige manier) verwijderd worden.
Op enkele plaatsen in de wereld is het mogelijk om tijdens de operatie een MRI-scan te maken (intra-operatieve MRI). De ervaringen daarmee zijn nog beperkt, de kosten zijn enorm hoog, en de sterkte van de magneet (hoe sterker de magneet, hoe scherper de plaatjes) is nog verre van optimaal. De idee achter deze toepassing is dat tijdens de ingreep kan worden gecontroleerd of voldoende tumorweefsel verwijderd is. Tot nu toe is de winst die een dergelijke aanpak voor de patiënt oplevert nog niet aangetoond.
Voor welke techniek of methode van opereren ook wordt gekozen, de inzet van operatie zal altijd zijn:
- Behoud van functie. De operatie mag dus in principe niet tot blijvende toename van uitvalsverschijnselen of tot nieuwe uitvalsverschijnselen leiden.
- Verkrijgen van een representatieve weefseldiagnose.
- Opheffen van de massawerking, dat wil zeggen verminderen van druk door de tumor massa op het omliggende hersenweefsel. Voor een biopsie geldt dat natuurlijk niet.
Complicaties van een operatie
Alle operaties hebben een bepaald risico. Dat geldt dus ook voor een hersenbiopsie of een craniotomie. Algemene risico’s hebben te maken met de narcose die eventueel gegeven moet worden. Specifieke risico’s van de operatie (biopsie of craniotomie) zijn infectie gevaar (als er een bacterie in het operatiegebied terecht komt. Die bacterie kan “van buiten” komen (uit de omgevingslucht, via de operatie-instrumenten of via de operateur). De kans hierop is uitermate klein, omdat met steriele instrumenten en onder steriele omstandigheden wordt gewerkt. Meestal treedt een infectie op die is veroorzaakt door een bacterie van de patiënt zelf, bijvoorbeeld via de huid, uit diens longen, gebit, of via het bloed. Ook de kans daarop is uiterst klein. De kans op een infectie is wat groter bij patiënten die bepaalde medicijnen gebruiken tegen hersenzwelling (dexamethason). Dat middel heeft namelijk een remmende werking op de afweer tegen infecties. Daarom krijgen deze patiënten altijd antibiotica toegediend in het infuus, vlak voor de operatie.
Een ander risico van een operatie van de hersenen is het optreden van een bloeding binnen in de hersenen. Dat kan bij een biopsie tijdens de ingreep gebeuren (beschadiging van een bloedvaatje bij het nemen van een “hapje”uit de tumor), maar dat kan ook na de ingreep gebeuren (een zogenaamde na-bloeding in het operatiegebied). Een dergelijke bloeding kan zonder verschijnselen blijven, maar een enkele keer ook levensbedreigend zijn. In dat geval is een spoedoperatie noodzakelijk, om de bloeduitstorting te verwijderen, en de oorzaak van de bloeding te behandelen.
Bij het opereren in en bij de hersenen is het risico op beschadiging van de hersenen altijd aanwezig. De neurochirurg is opgeleid om ongewenste schade aan de hersenen te voorkomen, maar toch is het niet altijd mogelijk om beschadiging te vermijden. Wanneer de tumor zich in of zeer dicht bij belangrijke hersengebieden bevindt, kan het manipuleren in dat gebied ertoe leiden dat er na de operatie uitvalsverschijnselen zijn, die er tevoren niet in die mate waren. Meestal zijn die nieuwe uitvalsverschijnselen van voorbijgaande aard, en soms worden die veroorzaakt door zwelling van de hersenen (hersenoedeem). Herstel treedt dan vaak al snel na de operatie op, eventueel door toediening van medicijnen die gericht zijn tegen de zwelling.
Patiënten die voor operatie al last hadden van epilepsie hebben een iets verhoogde kans op een epileptische aanval na operatie van een hersentumor, ook als ze al medicijnen tegen de epilepsie slikken. Soms krijgt een patiënt na operatie een epilepsie-aanval, terwijl hij/zij daar voor operatie geen last van had. Vaak is dat van voorbijgaande aard. Een epilepsie aanval na operatie kan echter ook het gevolg zijn van een na-bloeding. Als men dat vermoeden heeft, zal voor de zekerheid een CT-scan worden gemaakt.
Een complicatie die ook kan voorkomen bij een hersenoperatie is lekkage van hersenvocht. De hersenen drijven als het ware in hersenvocht, en dat vocht komt vrij als het vlies rondom de hersenen wordt geopend. Als de operatie wordt beëindigd, moet het hersenvlies waterdicht gesloten worden, om te voorkomen dat het hersenvocht via de opening in het hersenvlies kan ontsnappen. Soms is het niet goed mogelijk lekkage van hersenvocht te vermijden. In dat geval zal een tijdelijke drain worden geplaatst in de schedel, of in de rug, om er voor te zorgen dat de druk van het hersenvocht kunstmatig laag wordt gehouden. Op die manier kan de operatiewond verkleven, en wordt lekkage via de wond voorkomen. Een dergelijke drain moet meestal enkele dagen blijven zitten, om het gewenste effect te bereiken.
Het gevaar van lekkage is dat een infectie kan optreden door op de huid aanwezige bacteriën. Dat zou kunnen leiden tot een hersenvliesontsteking. Een hersenvliesontsteking geneest meestal snel na behandeling met antibiotica.
Daarnaast zijn er de complicaties van algemene aard zoals trombose, longontsteking e.d.
Vervolgbehandeling
Niet iedereen die een glioom heeft, krijgt dezelfde behandeling. Dit heeft niets te maken met verschillen van mening tussen artsen. Artsen handelen volgens richtlijnen die ze met elkaar hebben afgesproken en die zijn gebaseerd op wetenschappelijk onderzoek. Ook is er geregeld overleg met specialisten uit verschillende disciplines in neuro-oncologiewerkgroepen. U mag er daarom op rekenen dat u altijd de best mogelijke behandeling krijgt, waar ook in Nederland.
Bij de keuze voor een behandeling spelen een aantal zaken een rol:
- het type glioom
- de mate van kwaadaardigheid (gradering)
- de plaats van de tumor in de hersenen
- de leeftijd en neurologische en lichamelijke conditie
Type glioom
Eerder hebben we uitgelegd dat er verschillende typen gliomen zijn. De typen die het meest voorkomen zijn astrocytomen en oligodendrogliomen (en een mengvorm van beide). Deze twee typen kunnen hooggradig en laaggradig zijn. Bij de keuze van de behandeling wordt gekeken naar het type tumor dat u hebt. Zo blijkt het glioblastoom (de meest kwaadaardige vorm van een astrocytoom) het beste te reageren op een combinatie van bestraling en chemotherapie.
Gradering
Bij gliomen speelt de mate van kwaadaardigheid van de tumor een grote rol. Die kwaadaardigheid wordt uitgedrukt in graden. De gradering van een hersentumor is belangrijk bij het bepalen van de behandeling en het doen van voorspellingen over het verloop van de ziekte. Hooggradige gliomen (HGG) groeien snel en komen veel eerder in aanmerking voor een behandeling dan laaggradige gliomen (LGG). Bij laaggradige gliomen wordt de laatste tijd na een operatie ook vaak intensieve behandeling voorgesteld, terwijl voorheen in eerste instantie vaak voor een afwachtend beleid werd gekozen. Studies hebben aangetoond date r een belangrijke overlevingswinst is te halen bij deze tumoren.
Plaats van de tumor in de hersenen
De plaats van de tumor kan heel bepalend zijn voor de keuze van de behandeling. Een tumor kan bijvoorbeeld zo diep liggen dat een operatie niet mogelijk is. Een tumor kan ook in de buurt van hersendelen liggen die van levensbelang zijn, waardoor de tumor slechts gedeeltelijk verwijderd kan worden.
Leeftijd en conditie
Bij zware en ingrijpende behandelingen, zoals chemotherapie of een operatie kan de leeftijd een doorslaggevende factor zijn. Behalve iemands leeftijd speelt de lichamelijke conditie een rol. Hoe beter die is, hoe groter de kans dat een behandeling door het lichaam wordt verdragen en hoe kleiner de kans dat er complicaties optreden. Ook de combinatie van de leeftijd met de tumor gradering is van invloed op de keuzes, want bij oudere patiënten (boven de 50 jaar) met een laaggradig glioom (LGG) is men eerder geneigd om toch na de operatie een aanvullende behandeling te geven, terwijl bij jonge patiënten met een LGG vaker voor een afwachten beleid (“watchful waiting”) werd gekozen.
Na operatie kunnen verschillende paden worden bewandeld. In grote lijnen zijn er bij een hersentumor drie hoofdbehandelingen: operatie, bestraling en medicijnen. Deze worden geregeld gecombineerd. De operatie is hierboven al besproken. Hieronder volgt een uiteenzetting over de radiotherapie en de chemotherapie.
Radiotherapie (“nabestraling”)
Bij radiotherapie wordt gebruik gemaakt van röntgenstraling met een hoge energie. Als deze stralen door weefsel worden gestuurd, veroorzaakt dat een reactie tussen de straling en het weefsel. Er wordt een fysische reactie veroorzaakt, gevolgd door een chemische reactie. Die chemische reactie zorgt ervoor dat stoffen vrijkomen (ionen en radicalen) die beschadiging veroorzaken van de cellen in de directe omgeving. Op deze manier kunnen tumorcellen (maar ook gezonde cellen) worden beschadigd (waardoor ze zich bijvoorbeeld niet meer kunnen vermenigvuldigen) of gedood. Normale cellen hebben echter het vermogen om beschadigingen te herstellen. Tumorcellen kunnen dat veel minder goed. Om te voorkomen dat door bestraling te veel gezonde cellen worden beschadigd, wordt bij bestraling de totale dosis over een groot aantal kleinere porties verdeeld. De bestraling wordt gespreid over een periode van vele dagen tot een aantal weken. Daardoor krijgen de normale weefsels de kans om tussentijds te “repareren”, terwijl de (kwetsbare) tumorcellen langdurig worden beschoten met schadelijke straling.
Chemotherapie
Bij chemotherapie wordt gebruik gemaakt van medicijnen (cytostatica) die de vermenigvuldiging van cellen afremmen. Cytostatica zijn er in verschillende vormen, b.v als tablet, maar er zijn ook middelen die via een injectie of in een infuus moeten worden toegediend. Een behandeling bestaat meestal uit één of meerdere kuren, al dan niet in combinatie met een bestralingsbehandeling. Welke cytostatica toegediend worden is afhankelijk van het type glioom. Dit is afhankelijk van uw reactie op de medicijnen (de bijwerkingen) en het effect op de tumor. De medicijnen kunnen ernstige bijwerkingen hebben. Wilt u in aanmerking komen voor chemotherapie dan moet uw lichaam in een goede conditie zijn. Het was gebruikelijk chemotherapie alleen te geven in geval van terugkerende tumorgroei (recidief tumor), maar deze aanpak is aan het veranderen. Bij sommige typen tumoren (bijvoorbeeld het glioblastoom) is het nuttig gebleken chemotherapie in een eerder stadium, en tegelijk met de bestraling, te geven.
In de loop van de tijd kunnen ook aanpassingen van de behandeling noodzakelijk zijn. Een laaggradig glioom zal in de meeste gevallen in de loop van de tijd veranderen in een hooggradig glioom (dit heet “dedifferentiatie”). De tumor wordt dus agressiever. Om dat vast te stellen zal in de meeste gevallen een nieuwe operatie nodig zijn, waarbij materiaal wordt verwijderd dat door de patholoog zal worden vergeleken met het tumorweefsel dat bij de vorige operatie is onderzocht. Aanwijzingen dat een laaggradig glioom “onrustig” geworden is, zijn vaak op een controle MRI te zien: de tumor blijkt te zijn (aan)gegroeid, er is een verandering van het aspect (dus hoe de tumor er op de scan uitziet, bijvoorbeeld verhoging van de opname van het contrastmiddel). In andere gevallen bemerkt de patiënt zelf dat er dingen veranderen, bijvoorbeeld doordat er epilepsie optreedt (terwijl dat eerder niet zo was) of doordat er (nieuwe) uitvalsverschijnselen ontstaan. Dat kunnen tekenen zijn van verandering van de tumor, en zal aanleiding geven om een nader onderzoek te doen, en om uiteindelijk de behandelstrategie te veranderen.
Globaal behandelschema glioom
Bij verdenking op aanwezigheid van een laaggradig glioom (LGG):
- ofwel operatie:
- hersenbiopsie met weefseldiagnose LGG
- craniotomie met weefseldiagnose LGG + tumor verwijderen
- ofwel waakzaam afwachten (watchful waiting, niet behandelen en afwachten met MRI controles hoe de tumor zich ontwikkelt). Indien daarna bij controle scans aangetoonde groei of aankleuring op de MRI-scan optreedt: biopsie of craniotomie.
Bij een LGG volgt de laatste tijd steeds vaker bestraling of chemotherapie.
Vervolgbehandeling: dit is aan de orde indien er sprake is van aangetoonde groei van een LGG. In de meeste gevallen zal dan allereerst een nieuwe weefseldiagnose worden gedaan, hetgeen betekent dat wederom een operatie nodig is (biopsie of craniotomie), om na te gaan of er nog steeds sprake is van een LGG, dan wel of er in de tussentijd verandering van de laaggradige tumor in een hooggradig glioom (HGG) is opgetreden (“maligne degeneratie”).
Bij verdenking op aanwezigheid van een hooggradig glioom (HGG)
- in principe altijd operatie:
- Hersenbiopsie met weefseldiagnose LGG: zie boven
- Hersenbiopsie met weefseldiagnose HGG
- Craniotomie met weefseldiagnose + tumor verwijderen LGG: zie boven
- Craniotomie met weefseldiagnose + tumor verwijderen HGG
Bij HGG, indien de conditie van patient het toestaat: behandeling bestaande uit bestraling, chemotherapie of een combinatie van beide.
Artsen werken volgens richtlijnen. Soms wijkt men van een richtlijn af. Hier kunnen verschillende redenen voor zijn, zoals de situatie van de patiënt, wetenschappelijk onderzoek of nieuwe inzichten.
Van een viertal factoren is bekend dat ze van invloed zijn op de levensverwachting: tumorgraad, leeftijd, functieverlies en de hoeveelheid tumor die operatief kan worden verwijderd. Sommige van deze factoren zijn niet te beïnvloeden, zoals duidelijk is voor tumorgraad en leeftijd. Graad II tumoren hebben een betere prognose dan de graad III en die weer beter dan de graad IV gliomen. Ook is bekend, dat patiënten jonger dan 50 jaar een betere prognose hebben. Hoe verder boven de 50 jaar, hoe ongunstiger de verwachtingen zijn. En patiënten die in een goede algemene conditie zijn en bijvoorbeeld nog in staat zijn tot werken, hebben een betere prognose dan de patiënten die geestelijk en/of lichamelijk veranderd zijn en hulp nodig hebben voor algemene dagelijkse zaken als wassen, aankleden, boodschappen doen, koken en eten.
Wel lijkt het zo dat hoe meer tumorweefsel bij een operatie verwijderd kan worden, hoe beter het is. Vergeleken met een op het oog complete verwijdering is het ongunstig als alleen een biopsie voor de weefseldiagnose mogelijk is. De plek in de hersenen – en de mogelijkheid om risicoarm te opereren – is doorslaggevend voor de aard van een operatie. De ongunstigste categorie (graad IV, oudere leeftijd, niet meer zelfstandig functionerend, alleen biopsie) heeft een levensverwachting van minder dan een jaar. Jonge mensen met een laaggradige tumor kunnen jarenlang (vrijwel) zonder neurologische problemen leven en normaal werken. Als de tumor gaat ontaarden naar een slechtere graad verandert het toekomstperspectief.
Tenslotte
Een hersentumor is een zeer ernstige diagnose. Ondanks een meer gunstig beloop bij de laaggradige astrocytomen en de oligodendrogliomen gaat het bij de kwaadaardige vorm (het glioblastoom of astrocytoom graad IV) om een aandoening met een vrijwel altijd fatale afloop binnen een of twee jaar. Ondanks alle vooruitgang in de neurochirurgie bestaat er geen effectieve therapie, niet in Nederland en ook niet elders op de wereld. Alle therapie is er allen op gericht om de patient zo lang mogelijk en met zo min mogelijk bijwerkingen te laten overleven. Genezing is niet mogelijk. De patiënten overlijden doorgaans aan een recidief met verhoging van de druk in het hoofd, leidende tot toenemende sufheid en neurologische uitval. Deze laatste fase is door de ontluistering en het verlies van contact voor de omgeving akeliger dan voor de patiënt zelf, die er doorgaans geen weet meer van heeft. Een patiënt voelt geen pijn en slaapt doorgaans heel rustig in. Tijdelijk worden nog wel medicijnen (steroïden) gegeven, maar na enige tijd werken deze niet meer. Een verstandig arts zal zijn patiënten en hun familie dan ook adviseren af te zien van het zoeken naar allerlei “laatste strohalm” behandelingen en zich erop te richten het resterende leven zo aangenaam en makkelijk mogelijk te maken. Onderzoek naar betere behandelingen wordt op veel plaatsen verrricht en men hoopt dat er net als bij andere tumoren een doorbraak zal plaatsvinden.
Extra informatie:
- Kijk hier als u zich afvraagt of uw aandoening of behandeling consequenties heeft voor het uitoefenen van uw werk.
- Verder kunt u ook informatie vinden over hersentumoren via de site van het Radboudumc
- Via de site van https://hersentumor.nl/alles-over-tumoren-achtergrondinformatie/soorten-tumoren/gliomen kunt u ook informatie vinden over het glioom.
Bron: Nederlandse Vereniging van Neurochirurgen
Datum laatste revisie van deze tekst: maart 2020.